25 Feb Rimanere sempre concentrati
La chimica è una scienza esatta nella misura delle proporzioni. Una di queste proporzioni è la diluzione, che misura la quantità di un soluto in un solvente. Per esempio, il sale (NaCl) è solubile nell’acqua (H2O) fino a una concentrazione di 360 grammi per 1 litro (360g/l). Trattandosi di una reazione chimica, la dissoluzione dipende da tanti fattori, come per esempio la temperatura; nell’acqua bollente, non solo il sale si scoglie più rapidamente, ma può raggiungere una concertazione di 400 g/l. Inoltre, la diluzione ha notevole effetti su entrambi il solvente e il soluto: un’acqua satura di sale si congela sotto i -17° gradi Celsius, in quanto le molecole di cloruro di sodio si interpongono fra quelle d’acqua, impendendo la formazione di cristalli di ghiaccio.
Controllare le diluzioni è quindi di estrema importanza. Per ottenere delle soluzioni più concentrate si possono usare varie tecniche. Nel caso di un solido in un liquido, si fa evaporare il solvente fino a quando la concentrazione raggiunge il punto di saturazione e il soluto precipita (come si fa nelle saline); nel caso di due liquidi mescolati, si usa il differenziale dei punti di ebollizione (come avviene nella distillazione in alambicco: si raggiungono i 70° e l’etanolo evapora mentre l’acqua no). Ma poiché l’uso della temperatura può alterare le qualità chimiche delle molecole, a volte, si è obbligati allora a utilizzare altri mezzi fra cui la dialisi (una membrana semipermeabile lascia passare, per osmosi, il soluto in un fluido di solvente puro, riducendo la concentrazione del solvente).
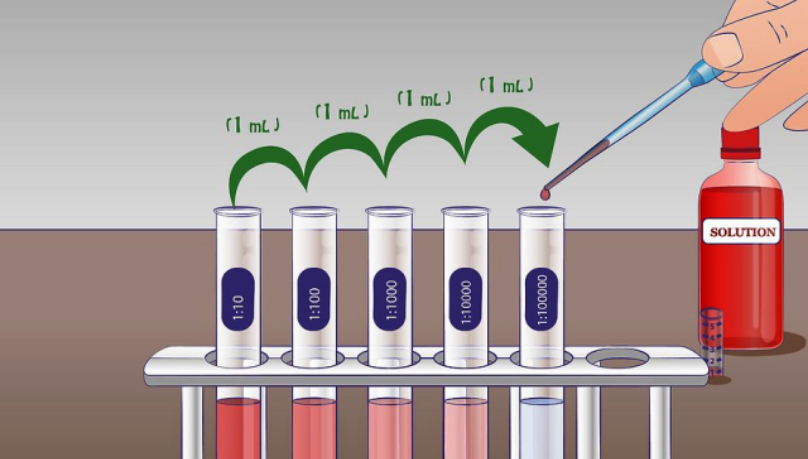
Il problema inverso è quello di aumentare la diluzione. Questa sfida potrebbe sembrare facile (basta aumentare la quantità di solvente), ma non lo è quando la quantità di solvente è limitata o costosa. Si usa allora una tecnica nota come “diluzione seriale”. La diluzione seriale è un metodo contro-intuitivo come si può vedere da questo esempio. Si immagini di aver un 1 litro di acqua satura di sale e 1 litro di acqua pura. Fino a che punto è possibile abbassare il tenore di sale nella soluzione satura? Se si versasse il litro di soluzione salina nel litro di acqua pura, la concertazione finale di sale nei due litri così mescolati scenderebbe del 50% (180 g/l). Se invece si prendessero 10 ml della soluzione satura in 90 ml della acqua pura, la concentrazione scenderebbe a un decimo di quella iniziale, ossia a 36 g/l; e se da questa soluzione diluita, si prendessero altri 10 ml mescolandoli con altri 90 ml d’acqua pura e si ripetesse l’operazione serialmente per altre dieci volte, la concentrazione si troverebbe divisa per 10 ad ogni passaggio, fino a 3,6 miliardesimi di grammo di NaCl per litro… ossia, 100 ml di H2O praticamene pura.
Stessi strumenti, rendimenti diversi, questa è l’essenza della diluzione seriale. Si possono ottenere buoni risultati nella vita, anche con pochi mezzi, basta aver la pazienza di applicarsi passo per passo, ripetendo gli sforzi senza perdersi d’animo e, soprattutto, non cedere alla tentazione voler ottenere tutto e subito.
